Эндоназальный электрофорез в офтальмологии
Оригинальный отечественный антигипоксант и антиоксидант прямого действия, оптимизирующий энергообеспечение клеток и увеличивающий резервные возможности организма Новости о препарате Мексидол Подробно о Мексидол для врачей Статьи Опубликовано в журнале: Бюллетень экспериментальной биологии и медицины, 2006, приложение 1 Н.А.Борисова, М.А.Иванова, Г.Н.Аверцев, Л.И.Байкова, К.Ф.Нигматуллина Клиника нервных болезней на базе Республиканской клинической больницы им. Г.Г.Куватова, Уфа Представлены результаты лечения ...
Эндоназальный электрофорез в офтальмологии Читать полностью "
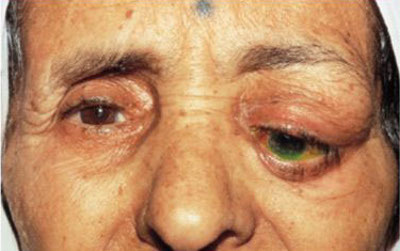
Шишка на верхнем или нижнем веке глаза — причины и лечение
Причиной этому служит множество факторов. Например, стремительное развитие компьютерных технологий и ухудшение экологической обстановки с каждым годом. Далее рассмотрим наиболее часто встречающиеся заболевания, а также выделим характерные для них симптомы. Патология зрительного нерва Глаукома – болезнь, имеющая хронический характер. Из-за повышения давления внутри глаз происходит дисфункция зрительного нерва. Вследствие падает зрение, которое в дальнейшем может ...
Шишка на верхнем или нижнем веке глаза — причины и лечение Читать полностью "
Шевеления и покалывания в глазах, выделения по утрам
Подписывайтесь на наш Instagram! Полезная информация о беременности и родах от ведущих акушеров-гинекологов Москвы и зарубежных экспертов: https://www.instagram.com/roddompravda/ Советы и мнения ведущих детских специалистов: https://www.instagram.com/emc.child/ Предвестниками родов принято называть внешние, реально ощутимые изменения в организме, которые являются непосредственной подготовкой к началу родовой деятельности. Ткани родовых путей — шейки матки, влагалища, вульвы, промежности — становятся достаточно эластичными, растяжимыми, ...
Шевеления и покалывания в глазах, выделения по утрам Читать полностью "
Что показывает исследование (осмотр) глазного дна?
Офтальмоскопия – осмотр глазного дна. Это визуальная оценка состояния диска зрительного нерва, артерий и вен сетчатки, а также ткани сетчатки. Глазным дном называют внутреннюю поверхность глазного яблока, которая выстлана сетчаткой. Для данного метода также иногда используют синоним «ретиноскопия». Осмотр глазного дна проводится в рамках как диагностики, так и динамического наблюдения за состоянием пациента. Офтальмоскопия – ...
Что показывает исследование (осмотр) глазного дна? Читать полностью "
Что означает минусовое зрение и как его корректировать?
По статистике Всемирной организации здравоохранения более миллиарда человек во всем мире живут с нарушениями зрения. По прогнозам ведущих мировых офтальмологов, половина населения Земли к 2050 году будет с диагнозом «миопия». Что это такое, как ее лечить и почему она возникает? Читайте в нашей статье. Что такое близорукость Близорукость — это дефект зрения, при котором изображение ...
Что означает минусовое зрение и как его корректировать? Читать полностью "